MDR1 - Multidrug-Resistance Transporter
Již před více než dvěma desetiletími byl poprvé pozorován klinický obraz této choroby u kolií, při níž v důsledku použití antiparazitika ivermectinu docházelo k rozvoji těžkých neurologických příznaků. Některá zvířata okamžitě po podání subterapeutické dávky ivermectinu vykazují příznaky zvracení, tremoru, poruch vědomí, křečových i komatózních stavů, zaznamenány byly i smrtelné případy. Jiná zvířata tohoto plemene naproti tomu tolerují podání i značně vyšší (terapeutické) dávky ivermectinu bez rozvoje neurologických příznaků. Tento fenomén byl označen jako „nesnášenlivost ivermectinu u kolií“. V dnešní době je známo mnoho účinných látek, které u různých plemen psů či kříženců mohou vyvolat neurotoxické symptomy s dramatickým průběhem.
Za to vše je zodpovědný defekt genu MDR1 u postižených zvířat. Pokud je tento defektní gen u zvířete přítomen, mohou určité (lipofilní) substance nekontrolovaně vstupovat do mozku a působit na nervových buňkách jako agonisté GABA receptorů. Těžké příznaky toxicity jeví ty případy, které nejsou ovlivnitelné žádnou specifickou terapií.
Mutace genu MDR1
Přecitlivělost na ivermectin i další medikamenty je způsobena defektem genu pro Multidrug-Resistance Transporter (MDR1).
Tento transportér slouží jako efluxní pumpa a sídlí především na membránách endotelových buněk, které vyplňují mozkové kapiláry. Vykonávají bariérovou funkci (hemato-encefalická bariéra), která zadržuje některé látky a toxické produkty a aktivně je transportuje zpět do krve. Tím zabraňuje přestupu takových substancí do nervové tkáně. Intaktní MDR1 protein bývá také označován za P-glykoprotein, který se skládá z 1280 aminokyselin a je zásadním stavebním prvkem hemato-encefalické bariéry. Pokud je defektní gen přítomen, poruší se syntéza MDR1 zhruba na 10 % původního proteinu. Defektnímu genu chybí 4 páry bází, po odhalení lokalizace defektu je mutace označována jako nt 230 (del4).
Defekt MDR1 – funkce
Kromě bariérové funkce mozku, varlat a placenty přebírá MDR1 protein metabolické funkce i v jiných tělesných orgánech. Je také exprimován ve střevě, játrech a ledvinách a účastní se metabolických procesů účinných látek v játrech a ledvinách. Dále MDR1 protein tvoří absorpční bariéru střeva. Pokud není MDR1 transport normální, vytrácí se na jedné straně bariérová funkce mozku/varlat/placenty, na druhé straně se mění farmakokinetika pro spoustu substancí kvůli zesílené absorpci, ale především jejich opožděné eliminaci. Důsledkem je fatální kumulace účinných látek a organismus je tak zahlcen toxickými substancemi.
Mimo to má MDR1 protein také transportní funkci v oblasti endokrinního systému. Intaktní MDR1 protein tak ovlivňuje přestup hormonů nadledvinek kortizolu a kortikosteronu do mozku. Pokud tato výměna není zajištěna, dochází k poruše regulace zpětnovazebného mechanismu (feed-backu) hypothalamus-hypofýza. Snížená bazální hladina kortizolu a útlum produkce hormonů štítné žlázy může být jeho důsledkem. U postižených zvířat to vede k nižší substituci hormonů štítné žlázy(subterapeutická dávka 1 mg na zvíře).
V jedné prospektivní studii z USA vykazují zvířata s defektem genu pro MDR1 zvýšenou náchylnost ke stresu (zřetelně snížená odpověď nadledvinek na stimulaci), ve srovnání se psy s intaktním genem pro MDR1, a pomaleji se také zotavují z těžkých onemocnění.
Ačkoliv byla mutace původně popsána u kolií, známe dnes nesčetné množství jiných psích plemen a kříženců, u kterých se vada zjišťuje.
Plemena
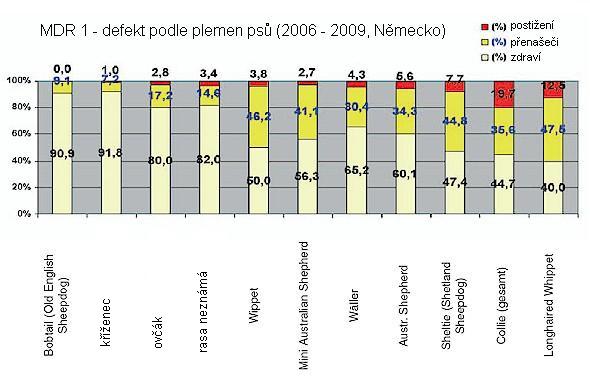
Postiženými plemeny jsou kolie (krátkosrsté i dlouhosrsté), australský pastevecký pes, anglický setr, sheltie, bobtail, border kolie, bílý ovčák (švýcarský), longhaired whippet, waeller (GER: australský pastevecký x briard), silken windhound (USA: barzoj x whippet)
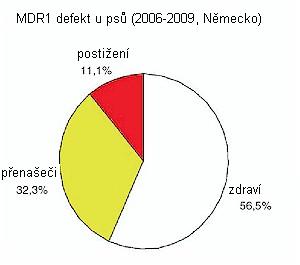
Výsledky vyšetření v LABOKLINu z let 2006 až 2009 ukazují, že cca. 57 % všech vzorků bylo pro mutaci genu MDR1 negativních, cca. 32 % byli nositelé genu, a 11 % byli postižení (homozygoti).
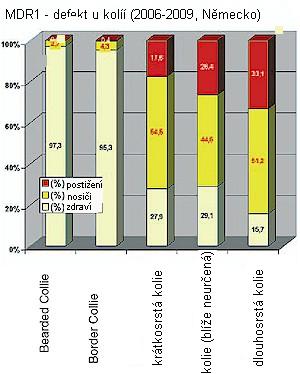
Asi 42 % obdržených vzorků pocházelo od psů plemene kolie, rozdělením skupiny kolií bylo cca 59 % blíže neurčených kolií (žádné detailní upřesnění druhu kolie u zaslaných vzorků), druhou nejzastoupenější skupinou kolií byly border kolie s cca. 22 %, po nich s 8 % dlouhosrsté kolie, 7 % krátkosrsté kolie a se 3 % bearded kolie.
Největší počet homozygotních jedinců byl zaznamenán u dlouhosrstých kolií ve 33 % testovaných zvířat. V rámci této skupiny dlouhosrstých kolií zaujímají vyjímečné postavení „americké“ kolie, u nichž nebyl zjištěn ani jeden negativní vzorek – 60 % vzorků pocházelo od postižených homozygotních jedinců, ve 40 % byli identifikováni jedinci „nositelé“ genu.
Ve skupině blíže neurčených kolií bylo 26 % vzorků homozygotních (postižených) psů, ve skupině krátkosrstých kolií bylo zjištěno 17 % homozygotních (postižených) jedinců. U dalších testovaných plemen bylo homozygotní postižení nejčastěji zaznamenáno u plemene longhaired whippet (12,5 %), dále u shettlandského ovčáka (7,7 %) a australského pasteveckého psa (5,6 %). U plemene bearded kolie nebyl zjištěn ani jeden homozygotní jedinec a pouze 2,7 % vzorků pocházelo od nositelů genu.
Léčiva
Je známo mnoho látek, které mohou spustit „ivermectinovou nesnášenlivost“ u zvířat s homozygotním MDR1-genotypem. Mezi známé substance (u kterých byla zjištěna interakce s multi-drug transporterem MDR1), způsobující neurotoxické až smrtelné příznaky, patří loperamid (Imodium ®) a makrocyklické laktony. Mezi makrocyklické laktony se řadí spousta antiparazitárních přípravků ze skupiny avermectinů (ivermectin, doramectin, moxidectin aj.). Pokud některý léčivý přípravek patří do této lékové skupiny, musí mít být jejich použití u psů výslovně povoleno. Tyto medikamenty nesmí být aplikovány žádným jiným než uvedeným způsobem a dávkováním (např. perorálně/topicky). Mezi povolené preparáty pro psa patří např. Stronghold ®, Advocate ® a Milbemax ®. U selamectinového preparátu Stronghold ® byla testována spot-on aplikace u MDR1-homozygotních kolií a nebyly pozorovány žádné příznaky intoxikace. Proto by se neměl měnit způsob aplikace doporučený výrobcem. Také u moxidectinového preparátu Advocate ® (obsahující moxidectin a imidacloprid) používaného odborným a doporučeným způsobem (spot-on), nebyla zaznamenána žádná intoxikace. Orální aplikace, místo výrobcem doporučeného topického podání, vedla i při menších dávkách k neurologické symptomatice, a je proto zakázána. Další z preparátů, který je možné použít u MDR1 homozygotních jedinců, ovšem jen v nízké terapeutické šíři, je Milbemax ® (milbemycinoxim). Krom milbemycinoximu obsahuje praziquantel a je výrobcem doporučován jako orální antihelmintikum a profylaktický přípravek dirrofilarióze (srdeční červivost). V jedné studii z USA vykazují ivermectin-sensitivní kolie při perorální aplikaci ihned po podání nízké dávky i proti údajům výrobce neurologické symptomy (zvýšená salivace, poruchy koordinace atd.).
U spousty dalších léčivých přípravků je interakce s MDR1 transportérem (na myších knock-out modelech) uváděna jako „pravděpodobná“. K nim patří především různá cytostatika, srdeční glykosidy, antiepileptika, opioidy, kortikosteroidy, antiemetika, antacida, antivirotika, antibiotika a antimykotika, imunosupresiva (např. cyklosporin) a jiná další (např. acepromazin). Washington State University doporučuje při používání aceptomazinu (např. Vetranquil ®) a butorfanolu (např. Torbugesic ®, Butomidor ®) u nositelů defektního genu redukci dávky o 25 %, u homozygotně postižených zvířat redukci dávky o 30-50 %, jelikož obě účinné látky mohou vést k prohloubení a prodloužení sedativního účinku. Při používání buprenorfinu (např. Temgesic ® aj.) nejsou žádná opatření o dávkování u MDR1 postižených zvířat doporučována, ačkoliv se interakce na MDR1 transportéru předpokládají. Další upozornění na interakce MDR1 transportéru s léčivými přípravky se nachází v odborné literatuře (např. Plumb´s Veterinary Drug Handbook, 2008)
| Název - účinná látka: | Použití: |
| Ivermectin | antiparazitikum (proti parazitům) |
| Loperamid | antidiarrhoikum (proti průjmu) |
| Selamectin | antiparazitikum (proti parazitům) |
| Digoxin | glykosid (působí na srdce) |
| Vincristin | cytostatikum (používá se při léčbě nádorů) |
| Vinbastin | cytostatikum (používá se při léčbě nádorů) |
| Ondasetron | antiemetikum (proti zvracení) |
| Doxorubicin | cytostatikum (používá se při léčbě nádorů) |
| Moxitectin | antiparazitikum (proti parazitům) |
| Cyclosporin A | imunosupresivum (potlačení imunoreakcí např.u transplantací) |
| Dexamethason | glukokortikoid (např.Cortizon) |
DNA test
Odhalení mutace vedlo k vyvinutí DNA-testu, s jehož pomocí je možné s vyšší jistotou odhalovat psy, u kterých se projevuje geneticky podmíněná „ivermectinová nesnášenlivost“. Pro DNA test je nejprve izolována DNA ze vzorku krve. Pomocí PCR (polymerase chain reaction) se získaný gen několikanásobně (milionkrát) nareplikuje, aby bylo možné jej jednodušeji analyzovat. Nakonec je pomocí molekulárně-genetických metod zjištována genová sekvence související s mutací nt 230 (del4). Tím je přímo prokázána mutace a takto psi s defektem genu MDR1. Genetický test poskytuje výsledky tří možných genotypů:
N/N: vyšetřovaný pes nenosí mutovaný gen a nemůže tak mutaci nt230 (del4) přenést na své potomstvo.
N/MDR1: vyšetřovaný pes je nosičem mutovaného genu a může mutaci nt230 (del4) přenést na své potomstvo s pravděpodobností 50 %. U těchto psů se nedá s jistotou vyloučit možnost lékové nesnášenlivosti až otravy po aplikaci rizikových látek (viz nahoře).
MDR1/MDR1: vyšetřovaný pes je čistý homozygot pro mutaci nt230 (del4), mutace postihuje oba chromozomy. Postižený pes přenáší mutovaný gen na další potomstvo. Homozygotně postižení psi mohou po aplikaci rizikových látek (viz nahoře) jevit příznaky otravy.
DNA test pro průkaz MDR1 defektu nabízí veterinárním lékařům a chovatelům dostatečný a téměř jistý prostředek k odhalení zvířat s ivermectinovou senzitivitou. Tento DNA test může odhalit ihned po narození postižená zvířata, takže jednodušeji rozhodnout pro nebo proti nasazení terapie. Dále lze zodpovědně rozhodnout o chovatelských záměrech tak, aby došlo k eliminaci MDR1 defektu z chovu.
Zdroj: www.laboklin.de